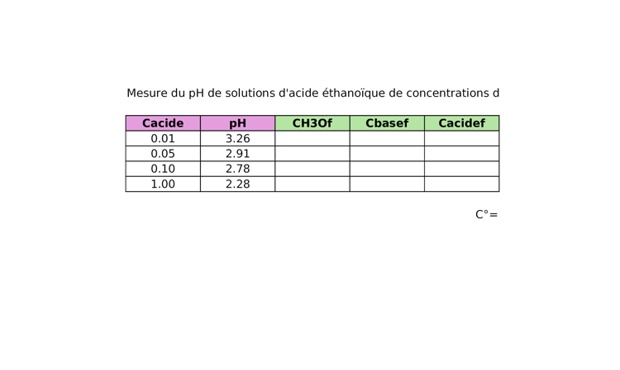
Corrigé - Préparation de solutions d'acide éthanoïque
Le fichier Regressi avec le corrigé est disponible ci-dessous.
Le tableur avec le corrigé est disponible ci-dessous.
1. Voir le fichier Regressi.
2. Sur le fichier Regressi, on crée une nouvelle grandeur calculée avec pour expression CH3Of =10^(-pH).
3. D'après l'équation de réaction, on forme la même quantité de matière en ion éthanoate \(\mathrm{CH_3CO_2^-}\) qu'en ion oxonium, donc on a \(C_\mathrm{CH_3CO_2^-,f}=C_\mathrm{H_3O^+,f}\). Sur le fichier Regressi, on crée donc une nouvelle grandeur calculée avec pour expression Cbasef=CH3Of.
4. D'après la stoechiométrie de la réaction, on a pour chaque solution \(C_\mathrm{CH_3CO_2H,f}=C_\mathrm{acide,i}-C_\mathrm{H_3O^+,f}\). Sur le fichier Regressi, on crée donc une nouvelle grandeur calculée avec pour expression Cacidef=Cacide-CH3Of.
5. On remarque que, pour ces quatre transformations, tous les réactifs et tous les produits sont présents à l'état final. Ces transformations sont donc non totales, l'état final du système est un état d'équilibre chimique.
6. Sur le fichier Regressi, on crée donc une nouvelle grandeur calculée avec pour expression Qrf=(CH3Of*Cbasef)/(Cacidef).
7. On remarque que les valeurs obtenues de \(Q_\text{r,f}\) sont sensiblement les mêmes pour les quatre transformations alors que les milieux réactionnels n'ont pas la même composition initiale.
Remarque : cette valeur commune à une température donnée du quotient de réaction à l'état final est appelée constante d'équilibre. Elle est notée \(K(T)\) et est indépendante de la composition initiale du système.
Source : https://lesmanuelslibres.region-academique-idf.frTélécharger le manuel : https://forge.apps.education.fr/drane-ile-de-france/les-manuels-libres/chimie-tle-specialite-g ou directement le fichier ZIPSous réserve des droits de propriété intellectuelle de tiers, les contenus de ce site sont proposés dans le cadre du droit Français sous licence CC BY-NC-SA 4.0